A 2000-es évek első évtizedétől drámai fejlődés kezdődött az idegrendszer kutatásában. Számos agyi, idegi folyamatot eddig elképzelhetetlen részletességgel vizsgálhatunk, és jóval pontosabban megérthetünk, mint korábban. Ezek alapján várhatóan sok tankönyvet kell majd újraírni. Az új eredményekre alapozva pedig gyorsabban és sikeresebben lehet majd gyógyítani az idegrendszer betegségeit.
Mi ennek a gyors fejlődésnek az oka?
A fejlődésnek három alapvető módszertani-technológiai pillére van:
- Az idegi aktivitásban szereplő egyes molekulák funkciójának minden korábbinál pontosabb vizsgálati lehetősége, azaz a molekuláris biológia betörése az idegtudományba.
- Az egyes idegsejttípusok, agyterületek tetszés szerinti ki- és bekapcsolásának lehetősége, az ún. optogenetika alkalmazása az idegtudományban.
- A mikroszkópos vizsgálatok óriási fejlődése, azaz a szuperrezolúciós képalkotás elterjedése az idegtudományokban.
Mit jelent a molekuláris biológia betörése az idegtudományba?
Az idegrendszer nagyon sokféle idegsejtből áll, és minden egyes sejt nagyon sokféle molekulát termel. Ilyen molekulák például az idegi ingerületátvivő anyagok és az őket érzékelő fehérjék (receptorok). Ezek segítségével kommunikálnak egymással az idegsejtek.
Az idegrendszer működésének megértéséhez alapvető fontosságú, hogy tisztázzák, mi az egyes molekulák szerepe.
A molekuláris biológia módszereivel lehetővé vált, hogy a kutatók tetszés szerint vizsgálják a molekulákat. Bármelyik idegsejttípus esetében módosíthatják a sejtek által termelt molekulákat, és megnézhetik, hogyan változik ennek következtében az idegrendszer vagy az idegrendszer egy részének működése.
Egy példa: a GABA (gamma-amino-vajsav) nevű vegyület az egyik legfontosabb ingerületátvivő anyag az idegrendszerben. A GABA-t érzékelő molekulákból, a GABA-receptorokból azonban nagyon sokféle létezik. Ezeken a receptorokon hat az idegrendszer gyógyszereinek jelentős része, altatók, fájdalomcsillapítók stb. Állatkísérletekben ma már megoldható, hogy a kutatók kiválasztanak egyet a sokféle GABA-receptorból, módosítják, és csak ennek az egynek a hatását vizsgálják különféle tevékenységekben, például a fájdalomcsillapításban, az alvásban vagy éppen az epilepszia kialakulásában.
Mi lehet ennek a gyakorlati haszna?
Ha az egyes molekulák pontos szerepe, működésük pontos helye tisztázódik, akkor ezt fel lehet használni a célzott gyógyításban. Már vannak olyan klinikai próbák, amelyek során egészen súlyos esetekben „hasznos” vírusok segítségével fehérjéket, ingerületátvivő anyagokat, gyógyszermolekulákat juttatnak be az emberi agyba azért, hogy lokálisan fejtsék ki a hatásukat. Például epilepsziás rohamokat okozó területre juttatnak be olyan molekulát, amely gátolja az idegi aktivitást. A Parkinson-kór esetében is körvonalazódik egy olyan új készítmény, amelyet célzottan juttatnak be az agyba, és amely képes megakadályozni a dopamintartalmú sejtek rohamos fogyását, vagyis a betegség okát.
Miért forradalmian új megközelítés az optogenetika alkalmazása az idegtudományban?
Ha korábban az egyes agyterületek szerepét vizsgálták különféle tevékenységekben – például evésben, alvásban, tanulásban –, akkor ezt úgy érték el, hogy vagy kiirtottak (inaktiváltak) bizonyos agyterületeket, vagy elektromos ingerléssel aktiválták őket. Azonban minden agyterületen sokféle idegsejt van, és az adott agyterület a sejtek mellett ide érkező és itt átfutó idegrostokat is tartalmaz. Egy agyterület működése ezen alkotóelemek kölcsönhatása révén valósul meg. E működést akkor értjük meg valójában, ha az egyes elemeket külön tudjuk vizsgálni. Erre azonban eddig nem volt mód.
Az utóbbi években azonban e téren is szédületes fejlődés következett be. Gyakorlatilag tetszés szerint lehet ki-be kapcsolgatni agyterületeket és idegsejttípusokat, azaz térben is, időben is kontrollálni lehet a működésüket. Így pontosan meg lehet mondani, mi az egyes agyterületek és sejttípusok szerepe egy-egy életfolyamatban.
A „kapcsolgatás” fénnyel történik. Felfedeztek ugyanis olyan – adott hullámhosszú fénnyel aktiválható – fehérjéket, amelyek egyben ioncsatornák is. Hasonló ioncsatornák kinyílása és bezáródása biztosítja az idegsejtek normális működését is. Amikor ezeket a fényérzékeny ioncsatornákat fény éri, akkor kinyílnak, és az idegsejtek vagy aktiválódnak (depolarizálódnak), vagy más fehérjék használata esetén inaktiválódnak (hiperpolarizálódnak).
A fényérzékeny ioncsatornát kódoló gént egy vírus segítségével juttatják be a vizsgálni kívánt agyterületre. A gén kifejeződik, azaz létrejönnek a fényérzékeny ioncsatornák, és beépülnek a módosítani kívánt idegsejtek membránjába. Ezután nincs más hátra, mint – akár száloptikával – nagyon célzottan megvilágítani az adott agyterületet, és a fényt ki-be kapcsolgatva vizsgálni a szerepét.
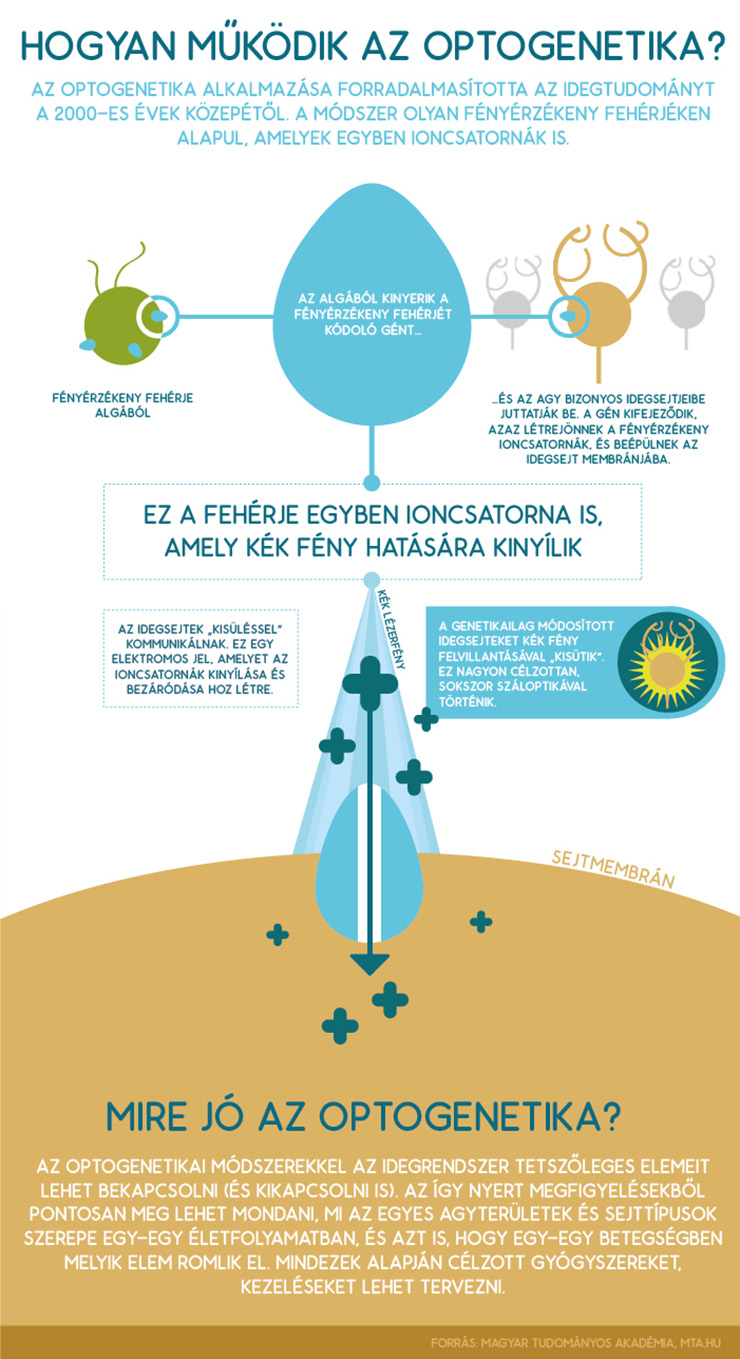
Forrás: mta.hu
Mi lehet ennek a gyakorlati haszna?
Az optogenetikai módszerekkel az idegrendszeri hálózatok egyes elemeit lehet ki-be kapcsolni tetszőleges módon. Az így nyert megfigyelésekből ki lehet következtetni az egyes elemek szerepét az egészséges agyi működésben, illetve azt, hogy egy adott betegségben melyik elem hogyan károsodott. Ennek alapján pedig célzott gyógyszert vagy kezelést lehet tervezni. Példa egy még közvetlenebb alkalmazásra: a retina degenerációja esetén jelenleg ilyen fényérzékeny molekulák szembe juttatásával próbálják megmenteni a látást.
Mit jelent a szuperrezolúciós képalkotás elterjedése az idegtudományokban?
Az idegrendszer szerkezetének felderítésére eddig fénymikroszkópot és elektronmikroszkópot használtak a kutatók. A fénymikroszkóp használata egyszerű, de finom részleteket nem lehet vele megfigyelni: az egy mikrométer alatti struktúrákat már nem képes felbontani (a mikrométer a milliméter ezredrésze). Pedig az idegrendszerben számos ennél kisebb dolog létezik, pl. az idegsejtek kapcsolódását biztosító szinapszisok csak néhány száz nanométeresek (a nanométer a mikrométer ezredrésze).
Az elektronmikroszkóppal láthatók a nanométeres szerkezetek is, ám használata roppant drága, körülményes és időigényes, ráadásul élő sejtet nem is lehet megfigyelni vele (a minta előállításának módja miatt).
Ebbe az óriási szakadékba tört be a szuperrezolúciós mikroszkópia, amely bizonyos trükkökkel átlépi a fénymikroszkópia feloldásának határát, és viszonylag egyszerű módszerekkel képes az elektronmikroszkópét megközelítő felbontásra. A 2014-ben kémiai Nobel-díjjal jutalmazott módszert Magyarországon az MTA KOKI-ban használták először. Szuperrezolúcióval akár élő sejtek szinapszisait is lehet vizsgálni, 20-40 nanométeres felbontásig.
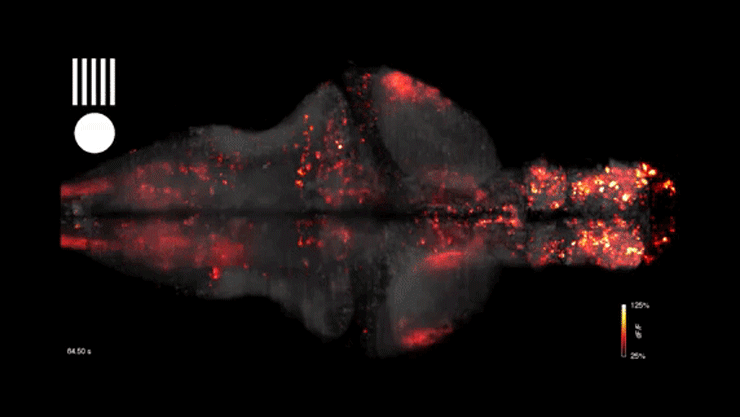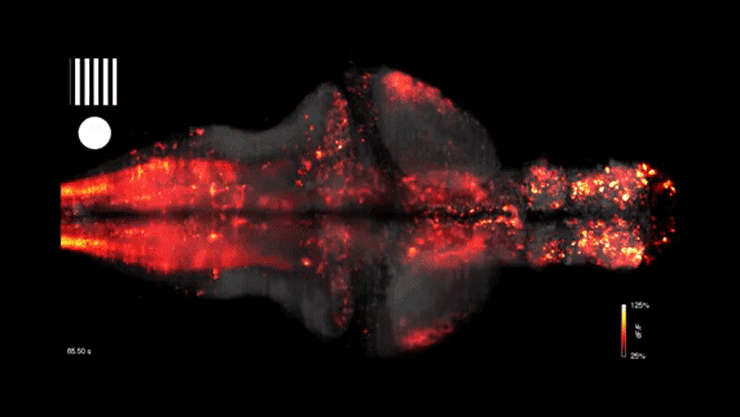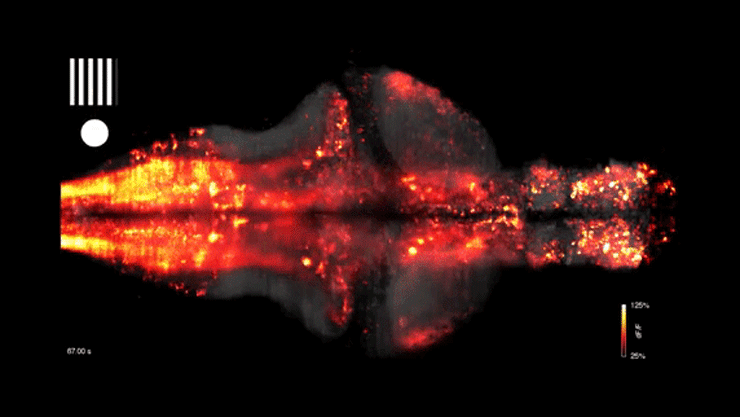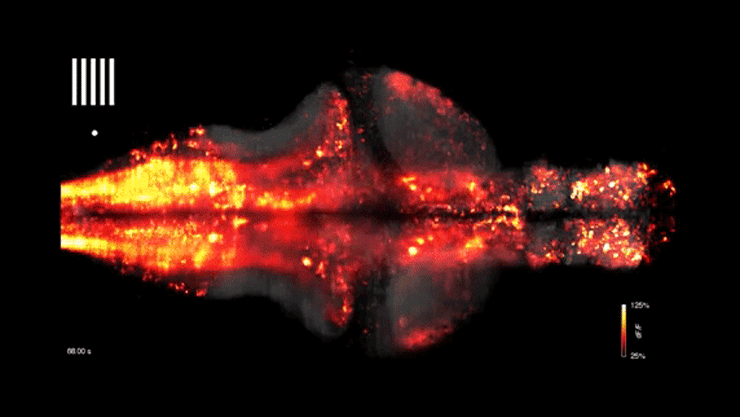
A cikk eredetileg az mta.hu oldalán jelent meg, a címlapképen egy zebrahal agyi aktivitásának vizualizációja látható – forrás: Youtube/WIRED Science