Roska Botond Svájcban élő neurobiológus, aki kutatásait az emberi látás visszaállításának szenteli. „Olyan vakság, amin egyáltalán nem lehet segíteni, nem létezik. Még azokon a betegeken is lehet valamennyit segíteni, akiknek a komplett látóidege hiányzik. Minden attól függ, hogy mennyi pénzt áldoznak rá” – mondta egy korábbi interjújában. A nemrég kiemelkedő privát és kantonális támogatással alapított Bázeli Molekuláris és Klinikai Szemészeti Intézet igazgatójával annak kapcsán beszélgettünk, hogy idén ő vehette át Magyarország legrangosabb kitüntetését, a Magyar Szent István-rendet.
Hogyan fogadta a hírt?
Nagyon váratlanul ért, eszembe sem jutott, hogy Magyarországról fogok kitüntetést kapni, hiszen 25 éve máshol élek, máshol dolgozom. A nagykövet úrtól kaptunk egy telefonhívást, aki burkoltan megkérdezte, hogy elfogadnék-e egy kitüntetést a köztársasági elnök úrtól. Nem is tudtam, hogy mi az, és július közepén érkezett egy levél, hogy a Szent István-rendről van szó.
Nagyon hálás vagyok érte, soha ennyire nem örültem díjnak, mint ennek, mert a többi díj – talán 12-13 ilyen nemzetközi díjam van az Egyesült Államokból, az Európai Unióból és Svájcból – mind szakmai díj, amit azért kaptam, mert a kutatócsoportom valamit csinált, amit értékeltek. De ez a magyar díj egész más. Én magyar ember vagyok, Magyarországon nőttem fel, Magyarországon formálták a szüleim, a tanáraim a gondolkodásmódom, és nagyon jólesett, hogy ez a közösség rám gondolt.

Roska Botond – forrás: IOB
A retinakárosodás utáni látás-visszaállítás sokáig a tudományos fantasztikum kategóriájába tartozott, és legfeljebb olykor felröppenő „kis színes” hírekben találkozhattunk ígéretesnek tűnő próbálkozásokkal. Annak alapján azonban, amit a kutatásairól nyilatkozott, a terápia nem csak távoli álom.
Többféle terápián dolgozunk, és közülük az egyik 13 év után elérkezett a klinikai próbákhoz. Ahhoz azonban, hogy megvilágítsam a módszer hátterét, érdemes visszaugranunk az időben a kutatásaim kezdeteihez. 2001-ben szereztem meg a PhD-fokozatomat Berkeley-i Kaliforniai Egyetemen, ahol a retina működésének megértésével foglalkoztam.
A kísérleti állatokból ki lehet operálni a retinát, mely lényegében kiteríthető, mint egy pokróc. Ha ennek az egyik oldalára, a fotoreceptorokra fényjeleket – például egy videót – vetítünk, a másik oldalon tudjuk mérni, milyen aktivitást mutatnak a különböző sejtek rétegei, végül pedig az információt az agyba továbbító látóideg. Ezekből a mérésekből világossá vált, hogy a retina sokkal több egyszerű fényérzékelő eszköznél, inkább egy intelligens számítógépnek tekinthető, amely az érzékelt képet 30 különböző, más képpé alakítja, és ezt az információt küldi tovább az agy felé. 2001-ben jelent meg egy publikációnk a Nature-ben, ami leírta a retinának ezt az alapvető funkcionális szerkezetét.
Korábban olvastam róla, hogy a retinában már megtörténik az élek, tehát a nagy kontrasztú átmenetek detektálása. Ezt is Önök fedezték fel?
Az éldetektálást már korábban leírták, mi viszont kimutattuk, hogy még legalább egy tucatnyi különböző dolgot csinál a retina, és a nyúl retinájával kapcsolatban azt is egészen pontosan leírtuk, hogy melyek ezek a funkciók. És persze az éldetektálás egy hangzatos szó, de hogy ez pontosan mit jelent, azt mi írtuk le, felállítva a folyamat pontos matematikai modelljét.
Ez volt az első szakcikk, amely megmutatta, hogy a retina nem egy feladatot végez el, hanem nagyon sokat egyszerre, és különböző dolgokat detektál a bejövő információból.
Gondolom, a retina működésének megértése mellett más is kellett ahhoz, hogy az elvesztett látás visszaadásán kezdjen dolgozni.
Ugyanebben az évben egy New York-i kollégám publikált egy cikket, amelyben megmutatták, hogy ha kivesznek legyekből három gént, és ezeket beteszik egy másik sejtbe, akkor ez a sejt fényérzékeny lesz. Amikor elolvastam a cikket, abban a pillanatban rádöbbentem, hogy ha én ki tudnék fejleszteni egy módszert, amivel ezeket a géneket be tudnám vinni egy adott típusú sejtbe a retinában, akkor egy vak retinában vissza tudnám hozni a látást. Ez 2001-ben egy ötlet volt, de akkoriban nem volt olyan módszer, amivel be tudtuk volna vinni a sejtekbe ezeket a géneket egy emberben. Így hát elmentem a Harvardra, és elkezdtem virológiával foglalkozni, hogy megtudjam, hogyan lehet géneket bevinni különböző sejtekbe.
2005-ben visszajöttem Európába, és megalapítottam a saját laboratóriumomat, a Neuronal Circuit Laboratoryt, a Friedrich Miescher Institute-ben Bázelben. Még ebben az évben kijött egy másik módszer, amelyben már csak egy gént kellett átvinni, és ez az egy gén is fényérzékennyé tudott tenni egy sejtet. Ekkor éreztem úgy, hogy itt az ideje, hogy mi is elkezdjünk ezzel foglalkozni. A laboromban ma nagyjából harmincan dolgoznak – a csapat egyik fele alapkutatással foglalkozik, a másik fele pedig új terápiák kifejlesztésével. 2008-ra kifejlesztettük az első olyan metódust, amellyel a retinában lévő bipoláris sejtekbe célzottan be tudtuk vinni ezt a fényérzékeny fehérjét. Egy teljesen vak egéren meg tudtuk mutatni, hogy visszanyertük a fényérzékelést a retinában, és az állat bizonyos látástól függő viselkedéseket el tudott végezni.
Jól értem, hogy ezek a bipoláris sejtek hétköznapi idegsejtek, nem fényérzékeny sejtek?
Igen, ezek egyszerű idegsejtek, soha nem válaszoltak a fényre, de a fotoreceptorok után ezek alkotják a retina második rétegét – a következő rétegben pedig az úgynevezett ganglionsejteket találjuk.
A bipoláris sejtek egyszerűen továbbítják az információt, vagy itt már sor kerül valamilyen mértékű feldolgozásra?
Itt már elkezdődik a feldolgozás, tehát ha nem a fotoreceptorok fényérzékenyek, hanem a bipoláris sejtek, akkor bizonyos látási funkciókat már elvesztünk, de még nem az összeset. Ez már nem lesz olyan látás, mint ha a fotoreceptorok működnének. Azonban ez még mindig jobb, mint ha a ganglionsejteket tennénk fényérzékennyé, ugyanis minél feljebb megyünk az architektúrában, annál rosszabb látást fogunk kapni.
Ez történt tehát 2008-ban, az eredményeket bemutató cikkünk a Nature Neuroscience-ben jelent meg. Két év múlva a Science-ben publikáltunk egy cikket, melyben azt mutattuk meg, hogy a fotoreceptoroknak, főleg a csapoknak jelentős része elég jól túléli a vakságot, csak elveszíti a fényérzékenységét. Ha pedig egy vírus segítségével specifikusan ezeket az úgynevezett túlélő fotoreceptorokat fényérzékennyé tettük, akkor a retina sok funkcióját vissza tudtuk hozni egerekben.
Milyen típusú vakságról van itt szó?
A vakságokat én alapvetően két típusra osztanám. Vannak olyan vakságok – ez az eseteknek nagyjából a fele –, amikor a fotoreceptorokkal történik valami, de a látóideg ép marad. És vannak olyan vakságok, amelyek a látóideget és a ganglionsejteket támadják meg. A mi módszerünk, amelynek során fényérzékennyé teszünk sejteket a retinában, nyilvánvalóan csak ott működik, ahol van látóideg. Ha nincs látóideg, akkor teljesen értelmetlen a retinát fényérzékenyíteni, hiszen nincs, ami közvetítse az információt az agy felé.
Nagyon fontos továbbá, hogy az általunk kifejlesztett módszernek különböző alfajai vannak. Az egyikben a túlélő fotoreceptorokat tesszük fényérzékennyé, de fényérzékennyé tehetjük a bipoláris sejteket vagy a ganglionsejteket is. Ez három különböző metódus, és mind a hárommal haladunk előre a terápia fejlesztésében, különböző cégekkel együttműködve. Mi addig visszük el a tudományt, amíg egy humánretinában meg tudjuk mutatni, hogyan működik a módszer, ezután cégeknek adjuk át az eredményt, és hosszú fejlesztés után végül rajtuk keresztül érkezik el az emberekhez a tényleges produktum, amit meg lehet vásárolni, és be lehet injektálni.
Mi tehát azokon a vakságokon dolgoztunk eddig, amelyekben ép a látóideg, és ezekben az egyik módszerünket, a ganglionsejteken alapulót egy kis cég elvitte emberi kipróbálásig: öt emberbe már be vannak injektálva a géneket hordozó vírusok, nem is kevés, 100 milliárd apró vírusrészecske.
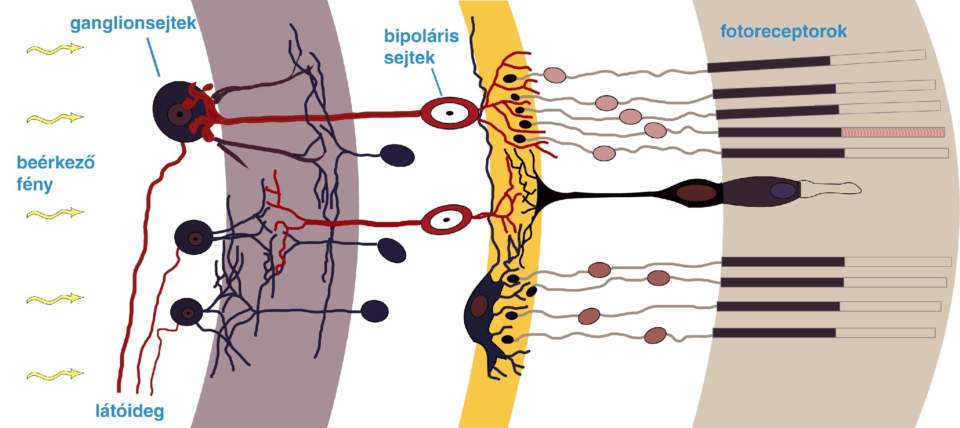
A retina vázlatos felépítése. A fény több átlátszó sejtrétegen áthaladva elérkezik a fotoreceptorokhoz, majd innen az általa keltett ingerület különféle idegsejtek – köztük a cikkben említett bipoláris és ganglionsejtek –hálózatán át végül eléri a látóideget – forrás: Wikimedia Commons/chris – CC-BY-SA
Mi van, ha elszabadul néhány ebből a százmilliárdból? Nem kell tartanunk a fertőzésveszélytől?
Ezek a vírusok úgynevezett dependovírusok, tehát önmagukban nem képesek replikálódni, ezért meglehetősen biztonságosak. Ezt a biztonságosságot nemcsak ennek köszönhetik, hanem annak is, hogy lényegében mindent kivettünk belőlük, ami eredetileg bennük volt. Teljesen szintetikusak, számítógéppel építjük őket, semmi közük sincs már az eredeti vírusokhoz.
A terápia során a vírusok bejutnak a sejtmagba, és ott is maradnak episzomálisan, vagyis a DNS-ük ott ül a többi kromoszóma mellett. Érdekes jelenség, hogy a sejt belső védelmi mechanizmusai valamiért nem bontják le ezt a DNS-t, amit más hasonló esetekben (szabad DNS-nél vagy plazmidnál) gyorsan megtesznek.
A ganglionsejtek célzása érkezett most el abba a szakaszba, hogy terápiaként tesztelhető. Három év múlva Bázelben, a mi intézetünkben a fotoreceptort is elvisszük idáig. Most alakul egy újabb kis cég is, amelyek a bipoláris technológiánkat viszik el emberbe. Itt tehát egy technológiasorozatról van szó, melynek egyik tagja eljutott a klinikai kísérletekig.
Ha tehát megvan a látóideg, alkalmazható ez a módszer?
Fontos elmondani, hogy ezek a módszerek csak tényleges vakságnál használhatók. A terápia ugyanis két részből áll: egyrészt beinjektáljuk ezeket a vírusokat a szembe, a másrészt pedig a beteg kap egy különleges szemüveget. Ez a szemüveg – egy kis cég fejlesztése – egy kifelé néző videokamerából, valamint egy befelé, a szembe vetítő projektorból áll, mely a kamera felvétele alapján adott hullámhosszon és intenzitással produkál egy olyan képet, amit ezek a vírusokkal bevitt fehérjék érzékelni tudnak. Ez azonban nagyon erős fény, ezért ha van még valamilyen megmaradt látása a betegnek, akkor ez a módszer nem alkalmazható.
Miben reménykedhetnek azok a betegek, akiknek a látóidegük sérült?
E téren is fejlesztenek terápiás módszereket, az egyik már klinikai stádiumban van: egy elektródamátrixot helyeznek el a látókéregben, és ezzel közvetlenül a látókérget stimulálják. Ezek a kísérletek már embereken zajlanak. E módszer egy másik, kifinomultabb formáján mi is elkezdtünk dolgozni. A retina és a látókéreg közötti területre, a talamuszba juttatjuk be a vírusokat, aminek eredményeként a talamuszból kiinduló és a látókéregbe vezető idegsejtek válnak fényérzékennyé. Ezek után elektródák helyett egy lézermátrixot (száloptika-mátrixot) nyomunk bele az agyba, mellyel képesek vagyunk stimulálni a fényérzékennyé tett idegsejteket. Ezek a kísérletek még nagyon kezdeti stádiumban vannak, évek munkájára lesz szükség, mire emberi terápiára alkalmassá válik a módszer.
Ezért mondom mindig arra a kérdésre, hogy mindenféle vakságot lehet-e gyógyítani, hogy a kutatók kezében ott vannak azok a módszerek, amelyekkel lehet segíteni, de időbe telik, amíg ezek eljutnak emberbe. Persze pontosan ugyanazt a látást, ami eredetileg volt, nyilvánvalóan nem tudjuk visszaállítani – hogy ez milyen mértékben sikerül, az az emberi kísérletektől és magától az egyéntől is függeni fog. Mert a látás folyamata tanult: az agyunk a retinából érkező információkat megtanulja, és a képet mi állítjuk elő az agyunkban. Az pedig, hogy hogyan tudunk majd elképzelni ilyen objektumokat, nagyban függ az illető tanulási képességétől.
Mit lát egy olyan ember, akinek a bipoláris sejtes vagy a ganglionos módszerrel visszaállították a látását?
Először is vegyük sorra azt, amit nem fog látni. Színeket egyelőre nem fog látni. Ez nem azt jelenti, hogy a jövőben sem lesz erre lehetőség, de ezzel a módszerrel egyelőre még nincs színlátás. És ami a különböző módszerek között jelentősen eltér, az a felbontás. A fotoreceptoroknál például azt reméljük, hogy elég nagy felbontást fogunk elérni – persze nem akkorát, mint egy egészséges embernél. Olyan, mintha különféle dioptriás látásromlást kapnánk – különböző módokon lesz elmosódva a kép. Teljesen tiszta képet nem fogunk tudni visszaállítani, de a legközelebb az egészséges látáshoz akkor jutunk, ha a fotoreceptorokba visszük vissza a fényérzékelés képességét.
Mintha már nem is annyira az lenne a kérdés, hogy visszaadható-e a látás, hanem az, hogy melyik módszer a legalkalmasabb erre.
Vannak egészen másfajta megközelítések a vakság kezelésére, csak azok sokkal kisebb embercsoportoknál működnek, és nagyon specifikus esetben. Az intézetünk például olyan terápián is dolgozik, hogy ha egy adott gén hiányzik, akkor azt a gént visszavigyük az emberbe. Az már nagyon specifikus, hogy pontosan milyen génről van szó, tehát ez sokkal kisebb embercsoportban használható, mert több százféle gén mutációja vezethet vaksághoz.
Alapvetően három nagy megközelítés van a vakság kezelésében. Az egyik a mutációindependens megközelítés – ilyen a mi terápiánk, amikor fényérzékenységet hozunk vissza optogenetikai módszerekkel. De vannak, akik beültetnek egy chipet a szembe, és elektródákkal próbálják visszahozni a látást. A másik, amikor a módszer géndependens, amikor egy gént viszünk be. Végül pedig a harmadik a mutációdependens, amikor a DNS-t magát szerkesztjük. Az intézetünkben jelenleg mindhárom terápián dolgozunk, de legelőször a korábban már bemutatott mutációindependens módszerünk érkezett el az emberi alkalmazáshoz.
Korábban készítettem interjút Rózsa Balázzsal, aki kutatócsoportjával az egerek elsődleges látókérgének információkódolásával foglalkozott. Úgy emlékszem, hogy volt Önök között együttműködés.
Valóban, együtt dolgozom Rózsa Balázzsal: ők mikroszkópot fejleszetenek, mi pedig ezeket a mikroszkópokat használjuk. Nagyszerű az együttműködésünk, azonban míg ők a látókéreggel foglalkoznak, mi inkább a talamusz ingerlésén dolgozunk, mert a látókéregben már nagyon bonyolult információk komputálódnak. Sokan sokféle módszerrel dolgoznak, meglátjuk, melyik módszer mit tud létrehozni emberekben.
Tehát Rózsa Balázsék csapatának mikroszkópfejlesztési „lábával” működnek együtt, nem pedig az elsődleges látókéreg kódolásának megfejtését célzó kutatásaikkal.
Mi is foglalkozunk a témával a retina és a talamusz mellett, azonban az együttműködésünk főleg a technológiákra koncentrál és a technológiák használatára.
A NAP első fázisának lezárultakor az volt az egyik fontos üzenet, hogy a magyar agykutatás immár megkerülhetetlen Európában, két éve pedig megkezdődött a NAP második négyéves ciklusa. Általában hogyan látszik külföldről a magyar agykutatás?
A magyar agykutatás nagyon elismert, szinte minden európai és amerikai kutató tud a magyar agykutatásról – nem tudom, ki fekteti bele a pénzt, de nagyon jól teszi. Jómagam tíz nemzetközi agykutató központnak és cégnek vagyok benne a felügyelőbizottságában, és mindenütt tudnak a magyar agykutatásról. Ha kutatókkal beszélek a világban, akkor Magyarországot a matematikáról, az agykutatásról és az orvostudományról ismerik. És az remek dolog, hogy Magyarország erre pénzt fordít, mert jobb helyre nem is tehetné.
Magyarországon jelenleg fontos téma az egyetemi rendszer átalakítása. Mit gondol, milyen irányba lenne érdemes továbblépni? Mi hiányozhat a magyar egyetemeken?
Ha megnézzük a sikeres országokat, akkor azt látjuk, hogy a kis országoknak van egy elitegyetemük, és van több jó, de nem világszínvonalú egyetemük. Egy kis ország nem tud eltartani hat olyan egyetemet, amely versenyezni tud a világ nagy intézményeivel. Ilyen például Belgiumban a Leuveni Egyetem, Angliában a Cambridge, az Oxford, az Imperial College és a UCL, Svájcban az ETH és az EPFL, Németországban a Müncheni Egyetem, a Freiburgi Egyetem, a Heildelbergi Egyetem, és Amerikának is van 12 elitegyeteme. Úgy gondolom, hogy az elitegyetem léte megkerülhetetlen, ha egy ország ki akar kerülni a nemzetközi színtérre. És egy kis ország, főleg ha mint Magyarország, nem egy gazdag ország, egyetlen elitegyetemet képes fenntartani. Ez az első meglátásom.
A második meglátásom ahhoz kapcsolódik, hogy egy évvel ezelőtt indítottunk el egy, a terápia fejlesztésével foglalkozó intézetet, ezért sokat kérdeznek különböző országokban arról, hogy milyen irányba haladunk itt, Svájcban. A tapasztalataim pedig azt mutatják, hogy a legtöbb országban az orvosi és a műszaki egyetemeket próbálják összekapcsolni. Azért, mert az emberiség legnagyobb problémája, amire a legtöbb pénzt fordítják a 21. században, az az egészségünk – legalábbis a nyugati államokban már biztosan ez a helyzet. És kik tudnak új terápiás eszközöket fejleszteni? Nos, a mérnököket arra képezik, hogy a meglévő tudásból gyakorlati dolgokat alkossanak. Svájcban is az zajlik, hogy az ETH-t, ami egy műszaki egyetem, megpróbálják összekötni az orvosi egyetemmel. Például itt, Bázelben, az én egyetememen az ETH elhelyezett egy tagozatot, és próbálnak további új, közös struktúrákat létrehozni az orvosi egyetemmel. De ugyanez a helyzet Amerikában is: azok az egyetemek sikeresek, ahol az orvosi és a műszaki kart össze lehet hozni egy tető alá.
A siker harmadik része pedig szerintem az, hogy az alapkutatással foglalkozó, független kutatóintézeteket az egyetemek köré érdemes építeni, és egy bizonyos adok-kapok viszonyt érdemes köztük kialakítani. Az egyetemnek azért jók ezek az intézetek, mert az ott születő cikkek sokat fognak számítani az egyetem nemzetközi értékelésében. A kutatóintézetnek pedig azért jó ez a kapcsolat, mert fel tudnak venni tehetséges diákokat, és a saját dolgozóik is be tudnak menni előadásokra. Azonban szerintem nagyon fontos, hogy legyenek önálló kutatóintézetek, mert az egyetemeken a tanítás lefoglalja az embereket, akik így nem tudnak 100%-ig a kutatással foglalkozni.
Nekem, bár egyetemi tanár vagyok az orvosi egyetemen, évi 3 órát kell tanítanom – ha ez heti három óra lenne, el lehet képzelni, mennyivel kevesebbet tudnék kutatni. Tehát a kutatóintézetek azért fontosak, mert itt folyik a legmagasabb szintű kutatás, de ennek valahogy az egyetemekhez kell kapcsolódnia, mert onnan jön az utánpótlás, és a kutatóknak is tovább kell tanulniuk. Hiszen sokszor úgy jönnek létre új technológiák, hogy egy kutató úgy érzi, érdemes egy új irányban továbbtanulnia.
Úgy látom, hogy ez a három pillére a modern, gazdaságilag is sikeres kutatásnak.
Gondolkodott-e azon, hogy hazatelepül, vagy valamilyen módon áthozza a tudását Magyarországra?
Rövid távon, az elkövetkező öt évben ez nem valószínű, mivel most indítottam el egy új intézetet. Svájc valaha adott egyik legnagyobb adományát, 200 millió dollárt kaptunk arra, hogy létrehozzunk egy ilyen, a látással foglalkozó kutatóintézetet, amit nyilván nem hagyhatok itt.
Hosszú távon soha nem tudtam megjósolni, hogyan alakul az életem, de többször felmerült, és nyitott is vagyok rá, hogy esetleg az intézetünknek legyen egy magyarországi részlege. Jelenleg ez abban nyilvánul meg, hogy szorosan együttműködöm a Semmelweis Egyetem Anatómiai és Szemészeti Intézetével, és Magyarországon is zajlanak közös kísérleteink Szabó Arnolddal és Nagy Zoltánnal. Emellett, ahogy korábban is említettem, Rózsa Balázzsal is nagyon szoros az együttműködésünk. Ha pedig lesz rá anyagi lehetőség, elképzelhető, hogy létrehozunk Magyarországon egy kisebb csoportot, amely célzottan az emberi retinák megismerésével és terápiák kidolgozásával foglalkozik. Ez attól függ, hogy érkezik-e ilyen ajánlat Magyarországról, és ha igen, akkor milyen nagyságrendű munkát tesz lehetővé.