A legújabb kutatások szerint civilizációs betegségeink – a magas vérnyomás, az elhízás, a cukorbetegség, az érelmeszesedés vagy a stressz – gyulladt állapotban, valósággal állandó készültségben tartják a szervezetet. Ez a készültség azonban hosszú távon többet árt, mint használ, és az eredménye sokszor az, hogy nagy baj történik az agyban. A gyulladásos folyamatokat, amelyek számos gyakori agyi betegség – mint a stroke, a depresszió, az epilepszia és az Alzheimer-kór – kialakulásában is komoly szerepet játszanak, alapjaiban csak most kezdjük megismerni. Összefoglaló a 2016-ban ERC Consolidator Grantet nyert Dénes Ádám kutatási témájáról.
Szinte már fel sem kapjuk a fejünket, ha a tévében egy fehér köpenyes orvos az elhízás, a magas vérnyomás vagy az érelmeszesedés hosszú távú veszélyeit taglalja, hiszen ezek a „civilizációs betegségek” szinte elkerülhetetlennek tűnnek. Az utóbbi évek eredményei alapján azonban az orvostudomány egyre többet tud arról, hogy ezek a milliókat érintő elváltozások hogyan is okozhatnak akár fiatal, akár idősebb korban valóban az életet veszélyeztető kórképeket.
Eme összefüggések egyik szeletének feltárásán dolgozik az ERC Consolidator Grant-nyertes Dénes Ádám. Hogy megértsük, mi is ez a szelet, érdemes fognunk egy gombostűt, és megböknünk vele az ujjunkat… no persze csak gondolatban!
Beteges készültség
Azon kívül, hogy esetleg pár csepp vért vesztünk, azt tapasztaljuk, hogy a szúrás helye kicsit kipirosodik, megduzzad, sőt, fel is melegszik, ráadásul még jóval a szúrás után is fáj. Ez pedig nem más, mint a gyulladás – szervezetünk így készül fel arra, ami a szúrás után következik: védekeznie kell a sebbe jutó kórokozók ellen, elszigetelni a sérült területet, és erőforrásokat átcsoportosítani a sérülés környezetébe, hogy hatékonyabban folyhasson a gyógyulás. A folyamat egyik korai lépése az, hogy az erek falának áteresztőképessége megnő, vérplazma és gyulladásos sejtek áramlanak a sérülés környékére: ennek következménye a kipirosodás, a felmelegedés és a duzzanat is.
Logikusnak gondolhatnánk, hogy a gyulladásos folyamatok csak a bejutó kórokozókra aktiválódnak, azonban a helyzet nem ennyire egyszerű. Testünk szeret jó előre felkészülni a bajra, így már a sérült sejtekből kiáramló egyes anyagok is gyulladásos reakciót váltanak ki, hogy mire a kórokozók valóban szaporodásnak indulnának, már kialakuljon az a környezet, ahol az immunrendszer hatékonyabban lecsaphat a betolakodókra. Ahhoz pedig, hogy a szervezet értesüljön a gyulladásról, és valóban komoly erőket mozgathasson meg a védekezéshez, szükség van egy igen érzékeny vészjelző rendszerre, továbbá olyan közvetítő molekulákra, amelyek messzire viszik a sérülés, fertőzés – és így a gyulladás hírét.
Ahogy a kutatók egyre többet megtudtak ezekről a gyulladásos faktorokról – ide tartoznak a kórokozók és sérült sejtek gyulladást kiváltó molekulái, valamint a fent említett közvetítők is –, rájöttek, hogy egy igen összetett rendszerről van szó, és rengeteg dolog van, amit ez az érzékeny rendszer gyulladást kiváltó okként kezel. Felfedezték, hogy az említett civilizációs betegségek – a magas vérnyomás, az elhízás, az érelmeszesedés, sőt a stressz vagy bármilyen szöveti sérülés – hatására bizonyos gyulladásos faktorok vérbeli szintje tartósan megemelkedik, és elkezdték vizsgálni, hogy milyen hatással lehet ez az állandó „készültségi állapot” a szervezet különféle szerveire és életfolyamataira.
Felfedezőút egy izgalmas határterületen
E kutatók közé tartozik Dénes Ádám is, aki a 2000-es évek elején kezdett el az immunológia és az agykutatás határterületével foglalkozni – így jutott el ahhoz a kérdéshez, hogy miként hatnak a gyulladásos folyamatok az agy működésére. 2005-től a Manchesteri Egyetemen Marie Curie-ösztöndíjasként a kutatási terület egyik megalapozója, Nancy Rothwell laboratóriumában dolgozott, majd 2008-ban a European Stroke Network Inflammation in Stroke (Gyulladás a stroke-ban) programjának szakmai vezetésére kérték fel Manchesterben. Ezután az MTA KOKI-ban alapított kutatócsoportot – ezzel a csapattal vág neki a 2016-ban elnyert Lendület-pályázat és az ERC Consolidator Grant által támogatott ötéves projektjének.

Dénes Ádám – forrás: mta.hu/Szigeti Tamás
Fontos megemlíteni, hogy a nyertes ERC-pályázat alapjául szolgáló kutatások nagy részét magyar forrásokból végezték. A mikroglia működésének megértésében nagy szerepe van a 2013-ban indult Nemzeti Agykutatási Programnak és egy OTKA-pályázatnak is. Dénes Ádám ERC-pályázatának megírását az MTA felkészítő támogatása is segítette.
De miért is annyira izgalmas határterület az agyi immunitás? Nos, az agy immunológiai szempontból különleges része a testünknek, hiszen bár a gyulladásos folymatok az agyban is elindulnak megfelelő stimulusok hatására, az agyszövetet védi a vér-agy gát. Az elnevezés kicsit félreérthető, hiszen itt nem egy nagy kapuról van szó, amire rábökhetnénk egy CT-felvételen, hanem egy specializált sejtekből álló rendszerről, amely korlátozza, hogy mi juthat át a vérből az agyszövetbe. A vér-agy gát nagyszerű szolgálatot tesz, amikor agyunkat fertőzésektől és különféle méreganyagoktól kell megvédeni, azonban az orvosok dolgát is igencsak megnehezíti: nem lehet akármilyen gyógyszert eljuttatni az agysejtekig.

Folyik a munka Dénes Ádám kutatócsoportjának laboratóriumában – forrás: mta.hu/Szigeti Tamás
A vér-agy gát az immunrendszer elemeinek sem ad szabad átjárást, így például a makrofágok, melyek egy szimpla bőrsérülésnél hamar ott teremnek, hogy bekebelezzék a kórokozókat és a sérült testi sejteket, csak korlátozott számban toborzódnak az idegszövetbe. Helyettesítésüket az agynak saját erőből kell megoldania – egyebek mellett ezt a feladatot is ellátják az úgynevezett mikrogliasejtek. A mikroglia egyedülálló sejttípus a szervezetben, amely elengedhetetlen a központi idegrendszer normális fejlődéséhez, és – számos egyéb szerepe mellett – felnőttkorban is folyamatosan ellenőrzi az agyi mikrokörnyezet állapotát, valamint koordinálja az agyi gyulladásos folyamatokat.
A kétes hírű mikroglia
És ezzel, némi kanyargás után el is jutottunk az akut agyi sérülések után kialakuló történésekhez, amelyek például stroke-ot követően figyelhetők meg. Amikor valaki stroke-ot kap, hirtelen megszűnik vagy minimálisra csökken egy nagyobb agyterület vérellátása, és az ezen a területen található idegsejtek haldokolni kezdenek. Ha sikerül helyreállítani az agyi keringést – például eltávolítani az elzáródást okozó vérrögöt, egyes idegsejtek még magukhoz térhetnek, és megmenekülhetnek a végső pusztulástól, míg mások, amelyek visszafordíthatatlan károsodást szenvedtek, elpusztulnak.
Ilyenkor lépnek színre a mikrogliasejtek, amelyek már az agyi sérülés korai szakaszában közreműködnek a bajba jutott idegsejtek aktivitásának szabályozásában, majd hasonlóan a test más részeiben működő folyamathoz, elkezdenek „takarítani”. Valahogyan persze meg kell állapítaniuk, hogy mely sejtek pusztultak el, melyek mutatnak visszafordíthatatlan károsodásra utaló jeleket, és melyek térhetnek majd magukhoz a későbbiekben. Ennek a folyamatnak a részletei és az agyi „bíróságok” döntéshozatali mechanizmusai még zömmel feltáratlanok.
A kutatók korábban csak annyit láttak, hogy mind a stroke, mind a különféle neurodegeneratív betegségek által érintett agyterületen mindig sok aktivált mikrogliasejt van jelen, és megfelelő vizsgálati módszerek híján nem lehetett eldönteni, hogy jelenlétük súlyosbította vagy enyhítette a stroke kimenetelét. A helyzet két szempontból is jelentősen különbözik a test más részein bekövetkező szövetpusztulástól:
- A szervezet legtöbb részén a szövetek képesek regenerálódni, vagyis ha elpusztulnak is sejtek, ezeket újabbak váltják fel. Az idegsejtekkel nem ez a helyzet. Ha az agyszövet egy része elpusztul, az elvesztett idegsejtek zöme nem pótolható – legfeljebb a megmaradó szövet „áthuzalozása” segíthet megőrizni vagy visszaállítani az eredeti funkciót.
- A stroke jellemzően idősebb korban következik be – olyan idős korban, ami néhány évszázaddal ezelőtt még csak keveseknek adatott meg, nem is beszélve az ősidőkről. Ráadásul ilyen korban az ember jellemzően már bőven túljutott a gyermeknemzés időszakán. Jogosnak tűnhetett hát az a feltevés, hogy az efféle nagymértékű agyszövetpusztulás elleni védekezésre nem igazán készített fel az evolúció, és meglehet, hogy agyunk takarítóinak „normál üzeme” ilyen esetekben több kárt okoz, mint hasznot. Ismert, hogy egyes gyulladásos faktoroknak egyébként fontos szerepük van az agy normális fejlődése és az agyi mikrosérülések regenerációja során.
A kérdés ott volt a levegőben, amikor az idegtudomány világán átsöpört a genetika és a mikroszkópia forradalma. Egyszerre elérhetővé váltak olyan módszerek, melyekkel élő állati szövetben is vizsgálhatóak lettek az idegsejtek működései – akár molekuláris szinten. (Erről bővebben a Rózsa Balázs és Katona István kutatócsoportjainak munkájáról írt cikkekben lehet olvasni.)
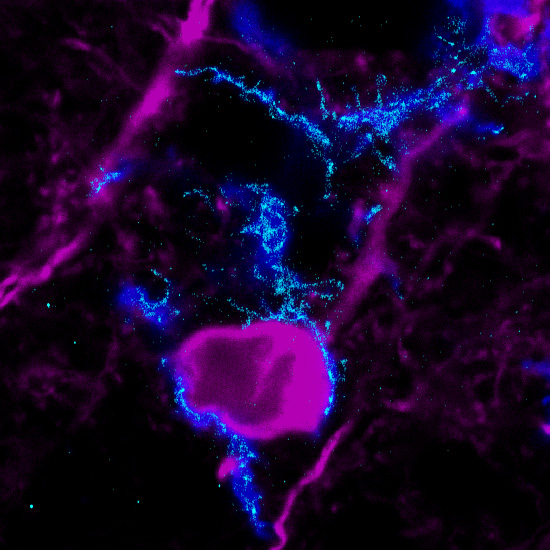
Szuperrezolúciós mikroszkópiás eljárással készített felvétel, mely a mikroglia-idegsejt kapcsolatokban kiemelkedően fontos receptorok eloszlását mutatja egy neuronnal kapcsolódó mikrogliasejt felszínén – forrás: MTA KOKI/Orsolits Barbara
Dénes Ádám mikroglia-kutatásait egy szerencsés véletlen is segítette: egy amerikai gyógyszergyár tumorsejtgátló hatóanyagáról kiderült, hogy a segítségével lényegében eltávolíthatók a mikrogliasejtek az agyszövetből, méghozzá nyomtalanul, vagyis anélkül, hogy pusztulásuk maga is gyulladásos reakciót váltana ki. Adott volt a módszer, hogy megvizsgálják, mi történik a stroke után, ha nincs ott a mikroglia.
Kommunikációs zavarok
A kutatócsoport ilyen „mikroglia-mentesített” egerekben mesterséges stroke-ot váltott ki, és figyelte, mekkora az idegsejtek pusztulásának mértéke. Az eredmény mindenkit megdöbbentett: a károsodás 60%-kal nagyobb volt, mint a mikrogliával rendelkező kontrollcsoportnál. Vagyis kiderült, hogy a mikroglia még ilyen extrém helyzetekben is az idegsejt legjobb barátja. De akkor mégis miért tűnik úgy, hogy a stroke-on átesett embereknél mintha súlyosbítaná a helyzetet?
Itt kerülnek a képbe a gyulladásos faktorok. A kutatásokból kiderült, hogy a mikrogliasejtek szabályozzák az idegsejtek különféle funkcióit, és a két sejttípus közti kommunikációban szerepet kapnak azok a gyulladásos faktorok is, amelyek az agyszövetben sérülés hatására termelődnek, vagy amelyek jelen vannak a vérben, és átjuthatnak a vér-agy gáton. Ha pedig szervezetünkben például a magas vérnyomás, az elhízás, az érelmeszesedés vagy a stressz következtében kialakul egy állandósult gyulladásos állapot, ezek a faktorok mindig jelen lesznek, és befolyásolják az idegsejt-mikroglia kommunikációt is. Az egereknél világosan látszott a jelenség: ha állandósult gyulladásos állapotot hoztak létre a szervezetükben, a stroke hatásai súlyosabbak voltak, míg a gyulladásos folyamatok gátlásával e hatások bizonyos mértékig visszafordíthatóvá váltak.
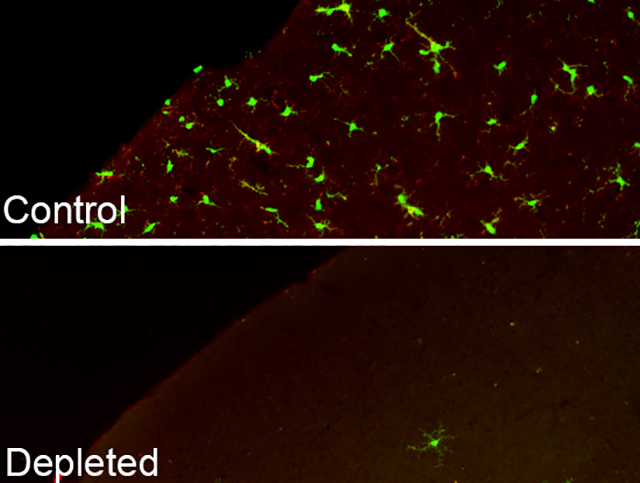
A mikroszkópos felvételen látható, hogy a gyógyszerhatóanyag hatására lényegében eltűntek a fluoreszcens molekulákkal jelölt mikrogliasejtek – forrás: MTA KOKI
Számos ilyen gyulladásos faktor létezik, Dénes Ádám kutatócsoportjának célja pedig az, hogy jobban feltárja ezek rendszerét és hatását az agy természetes védekezőképességére. Ha ezt a rendszert jobban megértjük, elképzelhető, hogy olyan gyógyszerek is kifejleszthetők, melyek egyszerűen csak abban segítenek a mikrogliának, hogy megőrizze eredeti funkcióját, és úgy viszonyuljon az idegsejtekhez, mintha a károsodást fokozó gyulladásos faktorok jelen sem lennének.
Egerek és emberek, no meg a stroke
„A KOKI ideális helyszínnek bizonyult ezekhez a vizsgálatokhoz – mondta el Dénes Ádám. – A kutatóintézetben a vezetőség és a kutatók céltudatos munkájának eredményeképpen olyan tudásbázis és műszeres háttér állt össze az utóbbi években, amelyek saját tapasztalatainkkal és kísérletes, klinikai kapcsolatainkkal együtt tökéletes környezetet jelentenek egy ilyen ERC-program kivitelezéséhez.” A (nagyon is valóságos) példa kedvéért képzeljük most el, hogy a kutatócsoport egy gyulladásos faktor hatását szeretné vizsgálni.
Az inspiráció számos helyről érkezhet, de a legjobb, ha valami köze van a klinikumhoz, tehát olyan folyamatokat, molekulákat vizsgálnak, melyek akkor mutatnak valamilyen szokatlan viselkedést, amikor egy beteg például stroke-on esik át. Az ilyen inspirációk származhatnak a szakirodalomból, de fontos információk érkezhetnek közvetlenül klinikai szakemberektől is: ilyen kapcsolat épült ki Csiba László és Hortobágyi Tibor debreceni kutatócsoportjaival vagy számos kiváló klinikus kollégával Budapesten. Nagy segítséget jelenthet az olyan egyedi „agybankok” szövetanyaga is, mint amilyet Palkovits Mikós hozott létre a Semmelweis Egyetemen. A KOKI-ban dolgozó kutatók így (szigorú etikai szabályok betartása mellett) hozzájuthatnak például egy stroke-ban elhunyt beteg agyszövetmintáihoz, kórelőzményeihez és egyebek mellett a stroke időpontjához közeli laborértékeihez.
Az itt felmerült kérdéseket azután szövettenyészeteken és élő egerekben is vizsgálni tudják. Így kiderülhet, hogy adott molekula milyen sejttípusokra van hatással, és immunjelölés, szuperrezolúciós mikroszkópia vagy elektrontomográfia segítségével azt is nyomon követhetik, hogy a sejteken belül hol található, és milyen folyamatokban játszhat szerepet. Egyedi módszerekkel vizsgálhatják a mikrogliasejtek szerepét az agyi vérkeringés változásaiban agyi sérülés után. Egy másik fontos irány a szintén KOKI-s Rózsa Balázs kutatócsoportjához köthető, amellyel együttműködve, kétfoton-mikroszkópia segítségével élő egerek agyszövetének vizsgálatára nyílik lehetőség, akár a sejtek nyúlványai szintjén, ráadásul élő állatban. További, hasonlóan fontos kollaborációk a KOKI-n belül és más hazai, illetve külföldi kutatóintézetekkel segíthetnek a mikroglia-idegsejt kapcsolatok neurofiziológiai hátterének megértésében, és így olyan nagy felbontású vizsgáló módszerek is igénybe vehetők, mint a proteomika vagy a transzkriptomika.
Ha pedig a gyulladásos rendszer egyik összetevőjéről ezekkel a kísérletekkel újabb adatokat tudtak meg, vizsgálni kell az érvényességüket az emberi szervezetben is. Ezeket az új kérdéseket pedig hol máshol tegyék fel, mint a klinikumban: ha már azonosítottak bizonyos jelenségeket az állatokban, illetve a szövetmintákban, az inspirációt ad arra vonatkozóan, hogy mit vizsgáljanak a kórházi leletekben.
Ezzel bezárult a kör, és a gyulladásos rendszer egyre jobb ismerete újabb és újabb lehetséges „támadási pontokat” fed fel a gyógyszerhatóanyagok számára. Szép példa erre az egyik gyulladásos hírvivő, az interleukin-1 receptorait gátló hatóanyag fejlesztése, mely már a klinikai vizsgálatok stádiumában van. Manchesterben – ahol Dénes Ádám nemzetközi karrierje indult – stroke-on, illetve úgynevezett szubarachnoidális vérzésen átesett betegeknél vizsgálják a hatásait. „Szerencsére kiváló kapcsolat maradt a Manchesteri Egyetem kutatóival és számos olyan kutatócsoporttal is, akikkel még a European Stroke Network időszakából ismerjük egymást – mondta el Dénes Ádám. – Ez az országhatárokon átívelő neuroimmunológiai műhely már a klasszikus idegtudomány művelőinek érdeklődését is felkeltette, és más kutatócsoportok adatai is utalnak arra, hogy az idegrendszeri betegségek esetén nem várható áttörés az agyi gyulladásos folyamatok átfogó megértése nélkül.”
Vissza az alapokhoz
Dénes Ádám kutatási témája és a megvalósítás rendszere több szempontból is igen jól rímel az orvostudomány jelenlegi helyzetére.
Egyrészt a kutatásban egy egész szervezetet érintő, összetett rendszert vizsgálnak, és egyre világosabbá válik, hogy több, eddig külön kezelt betegség okai összefügghetnek. Így például világossá vált, hogy a baktériumok sejtfalában található, gyulladást kiváltó molekulák nagyon hasonló vagy sok esetben azonos sejtfelszíni receptorokat aktiválnak az emberi immunrendszerben (az agyban is), mint az Alzheimer-kórban az agyszövetben plakkok formájában lerakódó úgynevezett amiloidok, illetve a cukorbetegek hasnyálmirigyében vagy a Crohn-betegek bélfalában nagy mennyiségben felhalmozódó hibás fehérjék.
Dénes Ádám szerint mára eljutottunk oda, hogy az orvostudomány sok esetben tapasztalati úton felfedezett és innen továbbfejlesztett vívmányai kezdik elérni lehetőségeik határait. Egyre több területen érdemes egy kicsit hátralépni, újraértelmezni a tapasztalatokat, és új alapokra helyezni a szervezet működésének megértését. Így talán olyan összetett kérdésekre is választ kaphatunk, hogy létezhet-e egyáltalán egészséges öregedés – jelenleg ugyanis az orvostudomány javarészt a különféle krónikus betegségekben eltöltött évek számát képes megnövelni, gyógyszerekkel fedve el e betegségek hatásait.
Másrészről a kutatás felépítése jó példát mutat arra, hogy a rohamosan fejlődő mérési módszerek által adott hatalmas klinikai adattömeget miként lehet felhasználni az alapkutatásban, és ezáltal hogyan közelíthető a sejtszintű vizsgálatok és az állatkísérletek világa a betegek valós, életminőségüket súlyosan befolyásoló problémáihoz.
A címlapkép forrása: mta.hu/Szigeti Tamás