A koponyacsont alá beültetett áttetsző mikroelektród-hálózatok alkalmazásával a csúcstechnológiás mikroszkópok pontossága és sokoldalúsága mellett az elektrofiziológia rendkívüli sebessége is kihasználható. Ahhoz azonban, hogy ez az érzékelő hálózat megmaradhasson az agy közvetlen felszínén, és a mikroszkópokat se zavarja, anyagtechnológiai bravúrokra van szükség. Fekete Zoltán és kutatócsoportja több áttörést is elértek az utóbbi években e területen.
Amikor a kutatók közvetlenül szeretnék vizsgálni a működő agy elektromos folyamatait, számos lehetőség közül választhatnak, azonban a módszereknek előnyeik mellett minden esetben gyengéik is vannak:
- Választhatják a koponyán kívüli (nem invazív) eljárásokat, mint az elektroenkefalogram (EEG). Ezek rendkívül gyors módszerek, ezredmásodperces időbeli felbontással képesek mérni nagy területen az agy elektromos aktivitását, azonban a térbeli feloldásuk igen gyenge – vagyis nem sok információt adnak arról, hogy a koponyán belül pontosan melyik apró agyterület mivel járul hozzá a mért eredményhez.
- Dönthetnek a legmodernebb mikroszkópos eljárások mellett. Ilyenkor nagyon erős, akár mikrométeresnél is finomabb térbeli feloldással közvetlenül vizsgálhatják az idegsejthálózat aktivitását – rendszerint egy koponyán létrehozott üvegablakon keresztül (lásd áttekintő cikkünket). Ha azonban egy nagyobb agyterület együttes működését szeretnék felderíteni, a pásztázás lassúsága miatt csökken az időbeli felbontás.
- Végül létezik egy harmadik lehetőség is: egy mikroelektródákkal sűrűn teleszőtt hálót helyeznek el az közvetlenül az agy felületén, mely képes gyorsan, az EEG-nél jóval nagyobb térbeli felbontásban érzékelni az agy elektromos aktivitását. Itt nyomban felmerül jó pár kihívás: az elektródahálónak alkalmazkodnia kell a hozzá közvetlenül csatlakozó szövet finom elmozdulásaihoz, illetve mivel rajta keresztül jellemzően még mikroszkópos vizsgálatokat is végeznek, egyúttal átlátszónak kell lennie, és el kell viselnie degradáció nélkül a vizsgálati módszereknél használt gerjesztő fényimpulzusokat is. Mindeközben az sem árt, ha ezek az átmenő fényimpulzusok nem bolygatják az elektródaháló által mért elektromos jeleket.
Világos, hogy a harmadik lehetőség, ahogy az angol mondja, “best of both worlds”, vagyis egyesíti a két megközelítés előnyeit. Fekete Zoltán és kutatócsoportja pedig a Nemzeti Agykutatási Program támogatásával mindent megtesz azért, hogy elkerülhetővé tegye a felsorolt buktatókat.
Mit mutat a macskaszem?
A kutatók létrehoztak egy olyan poliimid és indium-ón-oxid vékonyrétegekből felépített rugalmas mikroelektród-hálózatot, mellyel macskák látókérgéről vezettek el vizuálisan kiváltott elektrofiziológiai jeleket. Ezzel egyidejűleg az ép agyfelszín funkcionális térképezését is elvégezték egy, az agyfelszínről visszavert, aktivitástól függő fényre érzékeny optikai leképezési technika (intrinsic signal imaging) segítségével.
A retinára vetített fényingerektől függően a regisztrált elektromos jelekből egy teljesítménysűrűség-térképet hoztak létre, mely hasonlóságot mutatott az agyfelszínről reflektált – véráram eredetű – optikai jelekből alkotott ún. egyedi kondíciós térképekkel.
A mikrorendszerek rétegszerkezetének rendkívüli stabilitását jellemzi, hogy a komoly mechanikai igénybevételt jelentő műtéti beültetés ellenére a határfelületek elektromos paraméterei nem romlottak jelentős mértékben. A mikroérzékelő megvalósításáról és a kapcsolódó elektrokémiai és in vivo kísérleti eredményekről a Sensors & Actuators B: Chemical folyóirat számolt be.
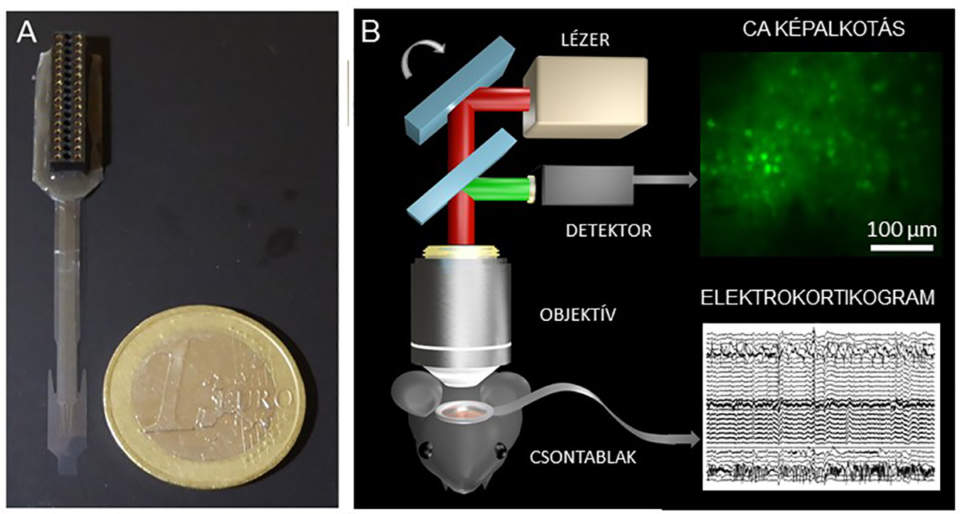
(A) Alacsony autofluoreszcenciával rendelkező Parylene HT hordozóból készült transzparens implantátum sokcsatornás intrakraniális EEG elvezetésére. (B) Sematikus ábra a fluoreszcensen jelölt egyedi sejtek és az agykéreg elektrofiziológiai aktivitásának egyidejű mérésére szolgáló kísérleti elrendezésről. Az implantátum az érintetlen agykéreg felszínén, a pásztázó lézer fényútjában helyezkedik el.
Az egéragy jelei
A projekt feladatai kiterjedtek a fluoreszcens képalkotással kompatibilis, transzparens mikroelektród-hálózat optimális szerkezeti kialakítására is. A kutatók célja az volt, hogy egy transzgén-egértörzs ép agykérgében kétfoton-mikroszkópiával gerjesztett fluoreszcens indikátorfehérje aktivitását monitorozzák, miközben közvetlenül a pásztázott terület felett epidurális EEG elvezetést is végeznek ezzel a mikroelektród-hálózattal.
A rugalmas elektródhálózat mikromegunkálásához gőzfázisból leválasztott poli-p-xililén, más néven Parylene HT és a fentiekben ismertetett indium-ón-oxid vékonyrétegek kombinációját alkalmazták. Az anyagszerkezet mechanikai terhelhetőségén túl, annak funkcionális élettartamvizsgálatát is elvégezték: az eredmények az EEG elvezetéshez nélkülözhetetlen elektromos paraméterek stabil viselkedését mutatták.
Az igen alacsony autofluoreszcenciával rendelkező szerkezettel akár 51 napon keresztül is sikeresen detektáltak egyedi sejtek aktivitására utaló fluoreszcens kalciumszignálokat, több száz mikrométeres mélységből is. A tesztek alapján az integrált érzékelő elektródák a pásztázási paraméterek széles tartományában képesek műtermékmentesen regisztrálni az agykérgi elektrofiziológiai aktivitást is.
A meglehetősen alkalmazás-orientált kísérleti eredményekről készült kéziratot a szakterület egyik vezető folyóirata a Journal of Neural Engineering közölte.
Alakmemóriával rendelkező polimerekből – a projekt keretében – szintén készültek eszközök, melyekről Scientific Reports folyóirat hasábjain és az MTA honlapján is beszámoltak.
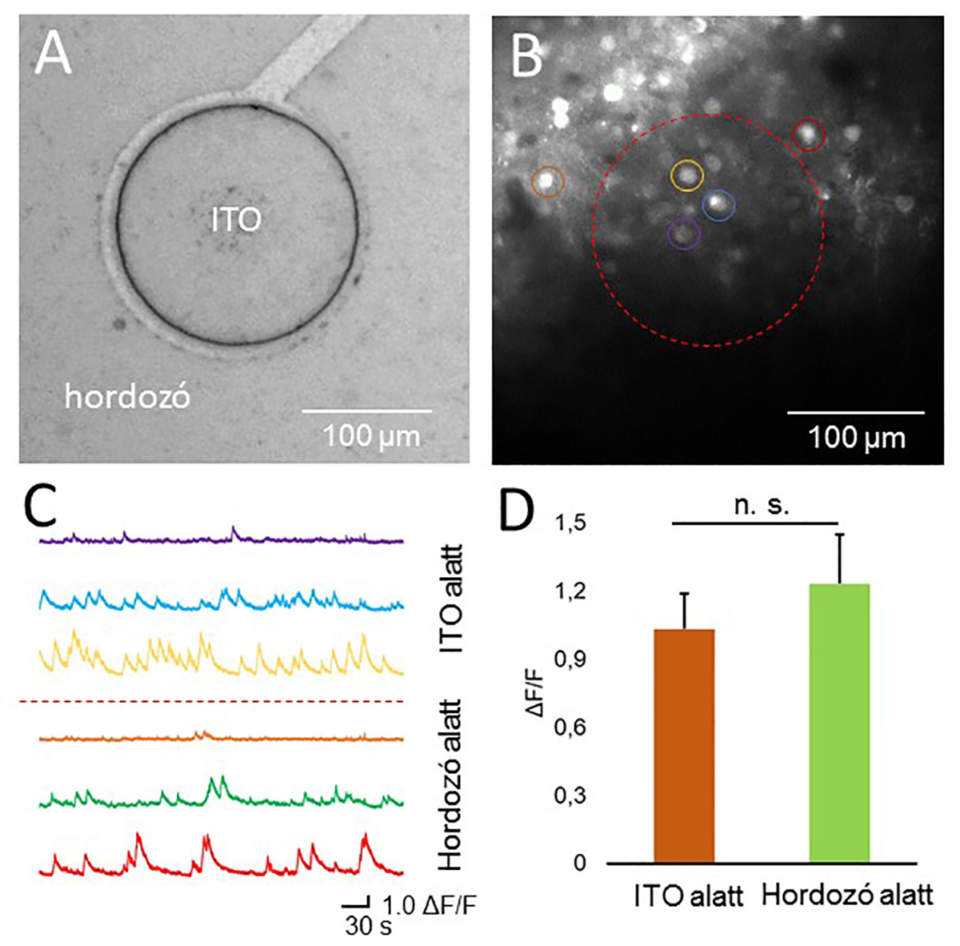
(A) A transzparens Parylene HT-alapú implantátum egy elektrofiziológiai elvezetőpontjának mikroszkópos képe. (B) Kétfoton-gerjesztéssel készült felvétel az agyfelszín és a szenzorhálózat alatt 250 µm mélységben. A világító foltok a GCaMP6f fehérjét kifejező, aktív (tüzelő) idegsejteket jelölik. A sejtaktivitás mind tisztán a hordozó, mind a szintén transzparens indium-ón-oxidból (ITO) készült elvezetőpont alatt is jól felismerhető. A szaggatott vonal az elvezető pont körvonalát, míg a színes körök a C ábrán bemutatott kalciumszignálokhoz tartozó idegsejteket jelölik. (C) A képalkotás során felvett, 5 perces, nyers kalciumszignálok. (D) A hordozó és az elvezetőpont alatt detektált, normált fluoreszcens intenzitás alapján származtatott kalciumcsúcsok. Anyagszerkezettől függetlenül a sejtaktivitást reprezentáló fluoreszcens jelek intenzitása között nincs szignifikáns eltérés.
Kiterjedt csapatmunka – az ötlettől a megvalósításig
A kutatócsoport vezetője a legfontosabb eredménynek azt tartja, hogy az ötlettől – számos technológiai buktatón átjutva – egészen a demonstrációig sikerült eljutni, ami alapkutatási feladatokban nem jellemző, főleg nem ilyen rövid időtávon. Kiemelendő, hogy Zátonyi Anita, a Pannon Egyetem PhD hallgatója mindhárom kapcsolódó originális közleményt első szerzőként jegyzi, elsősorban a mikrotechnológiai fejlesztésekben és az elektrokémiai vizsgálatok tervezésében, elemzésében betöltött meghatározó szerepének köszönhetően.
A mikroszerkezetek kialakítása az Energiatudományi Kutatóközpont Mikrorendszerek Laboratóriumában történt, míg az élő szervezetben végzett mérések az MTA-DE Idegtudományi Kutatócsoport és a PPKE Két-foton Mikroszkópiai Laboratóriumában zajlottak. Az in vivo kísérletek előkészítésében és a kinyert adatok elemzésében az ELTE Proteomika Laboratóriuma és a Wigner Fizikai Kutatóközpontjának Elméleti Idegtudományi Csoportja is aktívan közreműködött.
A projektmunkát a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal (NKFIH K 120143), a Nemzeti Agykutatási Program (2017_1.2.1_NKP-2017-00002), és az Új Nemzeti Kiválósági Program (UNKP-19-4-PPKE-9) támogatta.
Bővebb információk a kutatócsoport honlapján vagy a következő elérhetőségeken:
Fekete Zoltán, tudományos főmunkatárs, Pázmány Péter Katolikus Egyetem, Információtechnológiai és Bionikai Kar, Implantálható Mikrorendszerek Kutatócsoport
A címlapkép forrása: Flickr/Bryan Jones